Бобровский М.А. – ветеринарный врач терапевтического отделения ИВЦ МВА
Введение:
Плазма - ионизированный квазинейтральный газ, содержащий свободные электроны, положительно и отрицательно заряженные ионы. В простом понимании, плазму принято делить на низкотемпературную (106<К) и высокотемпературную (>106К), а также на равновесную и неравновесную. Исходя из того, что основным механизмом в равновесной плазме является тепловое сжигание, требующее высокой температуры рабочего газа, широкого применения в медицине, в отличии от неравновесной, она не находит.
Холодная неравновесная плазма атмосферного давления имеет ряд специфических, физических свойств оказывающих выраженный бактерицидный и биостимулирующий эффект. Эти свойства можно успешно использовать для контроля течения раневого процесса у животных.
Цель исследования:
Методами планиметрии изучить регенеративное действие низкотемпературной, неравновесной гелиевой плазмы атмосферного давления на стандартной модели септической раны у крыс.
Материалы и методы:
Объектом исследований является холодная, неравновесная гелиевая плазма атмосферного давления. Предметом исследований является влияние холодной неравновесной гелиевой плазмы на процессы регенерации тканей при лечении ран.
Все исследования проведены с соблюдением ГОСТР 52379-2005 - «Надлежащая клиническая практика» и ГОСТ 33044-2014 -«Принципы надлежащей лабораторной практики».
В качестве источника неравновесной плазмы, использовался аппарат для получения низкотемпературной плазмы генератор холодной плазмы, работающий на гелиево-воздушной газовой смеси. В качестве газовой смеси применялся гелий марки «Б» - ТУ 0271-135-31323949-2005 «Гелий газообразный (сжатый)». Гелий поставлялся в стальных баллонах, согласно ГОСТ 949, заполненный до давления 14,7 (± 0,5) МПа при 20 градусах Цельсия.
В исследовании использовались 30 аутбредных крыс линии Wistar в возрасте 8 месяцев - 15 самок со средним весом 151 (±13,8) грамм и 15 самцов со средним весом 179.2 (±11,6) грамм. После взвешивания животных (табл.1) проведена процедура рандомизации и формирования случайных выборок с распределением животных в одну из трех групп, по 10 животных (5 самок и 5 самцов) в каждой:
- Группа №1 – группа обработки холодной плазмой.
- Группа №2 – группа обработки 0.05% раствором хлоргексидина.
- Группа №3 – Контрольная группа сравнения. Животные данной группы обрабатывались 0.9% раствором хлорида натрия (плацебо).
Таблица 1.
Средняя масса тела животных в группах.
|
Группа №1 |
Группа №2 |
Группа №3 |
||||
|
Самки |
Самцы |
Самки |
Самцы |
Самки |
Самцы |
|
|
Ср. |
145,4 |
176,2 |
149,4 |
179,8 |
158,2 |
181,6 |
|
ст. ошиб.ср |
±8,4 |
±6,9 |
±4,0 |
±5,4 |
±5,0 |
±3,5 |
|
ст. откл |
±18,9 |
±15,5 |
±9,0 |
±12,2 |
±11,2 |
±7,8 |
Содержание лабораторных животных регламентировалось нормами нормам СП 2.2.1.3218-14. Кормление животных осуществлялось в соответствии с приказом министерства здравоохранения СССР №163 «О рационе лабораторных животных» от 10.03.1966. Для кормления лабораторных животных использовался полнорационный, экструдированный комбикорм для лабораторных животных ГОСТ Р51849-2011. Поение животных осуществлялось из поилок, водопроводной водой соответствующей ГОСТ Р 51232-98 «Вода питьевая».
Исследования проведены в соответствии с принципами Европейской конвенций о защите лабораторных животных; международными рекомендациями по проведению медико-биологических исследований с использованием животных, совета международных научных организаций 1985 года; приказом МО № 742 от 13.11.84 «Об утверждении правил проведения работ с использованием экспериментальных животных».
Моделирование септических ран осуществлялась посредством формирования полнослойной кожной раны и ее контаминацией St.aureus. Для усиления выраженности септического процесса, ежедневно, за 3 дней до формирования ран, животным инъецировался преднизолон, в дозе 0.2 мг на 100 грамм веса животных. Тем самым создавались умеренная иммуносупрессия животных. С целью формирования ран, животным внутримышечно вводилось 2,5мг тилетамина и 2,5мг золазепама. После анальгезии произведено удаление шерсти и обработка кожи дорсальной поверхности грудного отдела позвоночника, каудальнее лопаток, семидесятипроцентным раствором этилового спирта и спиртовым раствором йода. Скальпелем №11 сформирована равносторонняя рана с образованием поверхностного кожного дефекта. После формирования полнослойных кожных дефектов, осуществлялась контаминация ран 0.1мл суспензии St.aureus, в концентрации 108 КОЕ/мл, приготовленной в соответствии со стандартными образцами мутности Мак-Фарланда. Для предотвращения самоочищения ран путем саморазлизывания и взаимного разлизывания, производилось наложение на рану циркулярной бинтовой повязкой и ее укрепление бандажом из эластического бинта. Обработка ран начиналась через 48 часов, при появлении признаков острой воспалительной реакции, и проводилась ежедневно до заживления ран. Обработка ран холодной плазмой проводилась в течение двух минут с расстояния 1-1.5 см. Планиметрическая оценка регенерации ран осуществлялась через каждые 48 часов.
Планиметрические исследования осуществлялись модифицированным методом Л.Н.Поповой. Метод заключается в переносе контуров ран на гибкие полиэтиленовые пластины перманентным маркером. Полученные пластины сканировались поверх стандартного листа миллиметровой масштабно-координатной бумаги, ГОСТ 334-73, формата А4. Сканирование осуществлялось при помощи цветного сканера Canon i-SENSYS MF411dw, с разрешением 600x600 dpi. Расчетно-аналитические работы производились с помощью программы «ImageJ» посредством обработки полученных изображений.
Для оценки регенерации использовались показатели величины периметра и площади поверхности ран. Для расчета скорости регенерации раны использовались показатели процента уменьшения площади раневой поверхности за сутки по отношению к предыдущему результату а также средняя линейная скорость регенерации раны, показатель которой вычислялся по методу предложенному Осицевым Е.Ю. и Солободской А.Б.
Результаты и обсуждения:
За время проведения исследования, не выявлено статистически значимой разницы в показателях регенерации между первой и второй группами. Однако установлена статистически значимая разница меду первой и третьей; второй и третьей группами - р=0.04 и 0.05 соответственно. Рис. 1, 2.
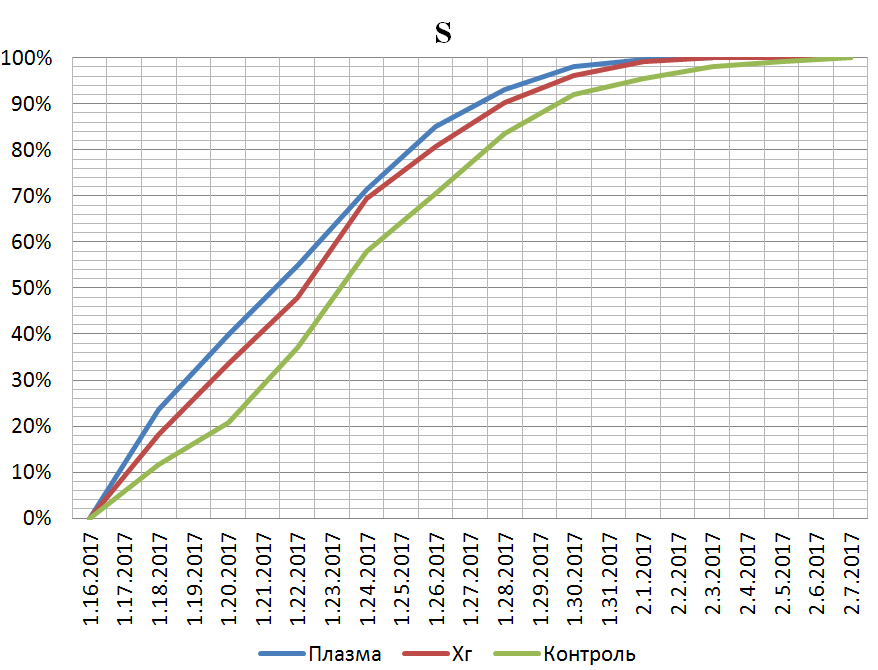
Рис. 1. Относительная убыль площади ран.
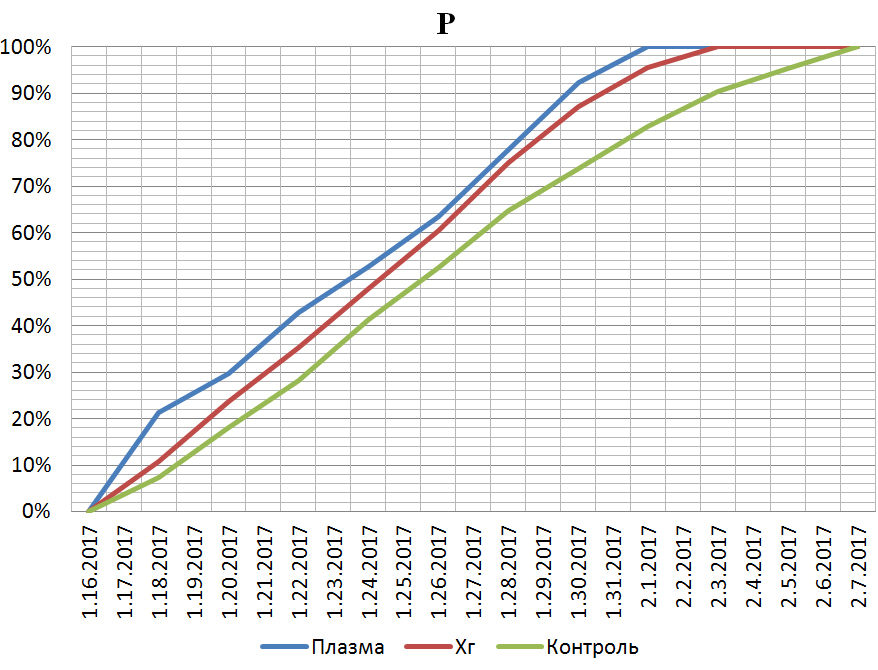
Рис. 2. Относительная убыль периметра ран.
На основании результатов проведённого исследования, можно установить наличие выраженного бактерицидного эффекта действия холодной плазмы, сравнимого по эффективности с действием хорошо исследованного местного антисептика – хлоргексидина. Несмотря на то, за время исследования не получено статистически достоверной разницы между действием холодной плазмы и хлоргексидином, раны обрабатываемые холодной плазмой, в среднем, заживали на два дня быстрее.
