Бобровский М.А. - Ветеринарный врач ИВЦ МВА, аспирант кафедры ветеринарной хирургии МГАВМиБ им.К.И.Скрябина.
Ветер Д.С. - Ветеринарный врач ИВЦ МВА, соискатель кафедры ветеринарной хирургии МГАВМиБ им.К.И.Скрябина.
Высокий уровень доместикации собак и кошек, высокая доля урбанизации этих животных и низкая осведомленность владельцев о правильном питании своих питомцев часто приводят к возникновению различных патологий желудочно-кишечного тракта, процессов обмена веществ, а также более серьезных системных заболеваний. Определенную долю данных заболеваний составляют алиментарные отравления продуктами питания человека, токсичными для животных. К наиболее распространенным среди них относятся шоколад, изюм, ксилит(заменитель сахара), а также лук и чеснок. Последние два продукта относятся к растениям рода Allium.
Allium – род двулетних и многолетних травянистых растений, относимых к подсемейст-ву Луковые (Alliaceae)семейства Амариллисовые (Amaryllidaceae). В роду более 900 видов, которые естественно произрастают в Северном по-лушарии. Дикие и домашние виды Allium давно используются человеком в качестве ингредиентов во многих блюдах и в народной медицине. Во всем мире имеются сообщения об отравлении домашних животных представителями рода Allium, но в общей доле всех пищевых токсикозов процент отравления животных представителями этого рода остается незначительным.
Все виды Allium и их производные могут быть токсичными для собак и кошек, но наибольшая инцидентность оправлений наблюдается при поедании животными репчатого лука (Alliumcepa) (Рис.1), чеснока(Alliumsativum) (Рис.2.), лука-порей (Alliumporrum) (рис.3.) и лука скорода (Alliumschoenoprasum) (Рис.4.).
Основными этиологическими факторами поедания животными этих растений являются спонтанное идиопатическое поедание сушеных концентратов (луковиц или листьев), а также искусственное – ятрогенное – чрезмерное введение этих продуктов в рацион животного. При этом добровольное поедание животными сочных частей растений наблюдается довольно редко из-за достаточно непривлекательных органолептических свойств, обусловленных содержанием пахучих эфирных масел и горечей, и наблюдается при поведенческих пищевых извращениях.
Из-за достаточно низкой инцидентности подобных отравлений не у всех практикующих ветеринарных врачей имеется представление о диагностике, патофизиологии и лечении данных заболеваний. Целью данной статьи является попытка обобщить имеющиеся сведения и поделиться с практикующими специалистами нашим опытом диагностики и лечения отравлений, вызванных растениями семейства Allium.
|
|
|
 |
|
| Рис. 1 Allium cepa | Рис. 2 Allium sativum | Рис. 3 Allium porrum | Рис. 4 Allium schoenoprasum |
Токсикологические данные
Луковицы и листья растений рода Allium содержат в своем составе азотистые вещества (до 2,5 %), различные сахара (10—11 %) (глюкозу, фруктозу, сахарозу, мальтозу), полисахарид инулин, фитин, флавоноидкверцетин и его глюкозиды, жиры, различные ферменты, со-ли кальция и фосфора, фитонциды, лимонную и яблочную кисло-ты, витамины A A, B1 , B2, PP , C , а также эфирное масло с резким особым запахом.
Основное патогенетическое значение имеют вещества, входящие в состав эфирных масел - дипропил дисульфид (H7C3S2C3H7) и аллил пропил дисуль-фид(H5C3S2C3H7). В последнее время имеются сведения, что натрия-n-пропил тиосульфат, выделенный из вареного лука, ведет к увеличению телец Гейнца в эритроцитах и развитию последующей гемолитической анемии. Так введе-ние собакам 500 ммоль/кг массы тела животного, натрия-n-пропил тиосуль-фата приводит гемолитической анемии, ассоциированной с появлением те-лец Гейнца, особенно при врожденной недостаточности глутатиона.
Механизм действия
Основным токсическим механизмом производных органических соединений серы в растениях рода Allium является внутрисосудистый гемолиз, развивающийся вследствие окислительного повреждения эритроцитов. Данное явление развивается при накоплении в них оксидантов в концентрации, превосходящей компенсаторную возможность антиоксидантной метаболической активности. N-пропил дисульфид и натрия-n-пропил тиосульфат являются крайне ядовитыми для животных сероорганическими соединениями, содержащимися в луке. Воздействие на эритроциты N-пропила дисульфида приводит к значительному снижению активности глюкозо-6-фосфатдегидрогеназы. Глюкозо-6-фосфатдегидрогеназа - первый фермент пентозофосфатного гликолиза. Основная функция фермента заключается в восстановлении НАДФ до НАДФН, необходимого для перехода окисленного глутатиона (GSSG) в восстановленную форму. Восстановленный глутатион (GSH) требуется для связывания активных форм кислорода (перекисей), накапливающихся в эритроците.
При снижении уровня восстановленного глутатиона или активности глюкозо-6-фосфатдегидрогеназы, необходимой для поддержания его в восстановленной форме, под влиянием перекиси водорода происходит окислительное денатурирование гемоглобина и белков мембраны. Денатурированный и преципитированный гемоглобин находится в эритроците в виде включений - телец Гейнца. Эритроцит с включениями быстро удаляется из циркулирующей крови: либо путем внутрисосудистого гемолиза, либо тельца Гейнца с частью мембраны и гемоглобина фагоцитируются клетками ретикулоэндотелиальной системы. В то же время под действием натрия-n-пропил тиосульфата происходит снижение восстановленного глутатиона, появление телец Гейнца и увеличение концентрации метгемоглобина. При этом компенсаторная активность другого внутриклеточного фермента - каталазы, которая катализирует разложение образующегося в процессе биологического окисления пероксид водорода на воду и молекулярный кислород, также является недостаточной.
Аллицин иаджоен (ajoene) – соединения, присутствующие в чесноке, являются мощными фармакологически активными веществами, влияющими на сердечнососудистую систему. В частности, они оказывают вазодилатирующий и гипотензивный эффект. Кроме того, аджоен и другие сероорганические соединения, выделенные из лука и чеснока, оказывают сильный противосвертывающий (антитромбический) эффект. Хотя, по мнению автора, данные эффекты у животных наблюдаются реже и проявляются при поедании достаточно большого количества чеснока, как вариант индивидуальной чувствительности. Указанные эффекты могут усугубить общее течение интоксикации.
Чувствительность и токсичность
Отравление животного происходит при однократном поедании большого количества или длительном поедании малых порций свежих, сочных частей растений (в основном луковиц или листьев), сока этих растений, а также сушеных концентратов, используемых для приготовления пищи (сушеные, измельченные луковицы чеснока и лука; сушеные, измельченные листья лука и др.).
На практике наиболее частыми являются отравления репчатым луком. Токсические эффекты наблюдаются при поедании 5г/кг репчатого лука у кошек и от 15 до 30г/кг у собак. Собаки с наследственно низким содержанием глутатиона более восприимчивы к окислительному повреждению эритроцитов. Эта особенность характерна для собак японских пород, в частности, акита-ину и сиба-ину. Другие врожденные нарушения, а также нарушения питания, приводящие к дефициту цинка и снижению антиоксидантной защиты (например, глюкоза-6-фосфатдегидрогеназа) эритроцитов, способствуют развитию гемолитической анемии под действием сероорганических соединений лука. Кошки более восприимчивы, чем собаки. По данным зарубежных авторов, отравление кошек может происходить при скармливании детского питания, некоторые производители которого добавляют лук и луковый порошок для усиления вкусовых качеств.
Эритроциты человека являются наиболее устойчивыми относительно других видов животных к воздействию дипропил дисульфида, аллил пропил дисульфида и натрия-n-пропил тиосульфата. Однако имеются сведения о чувствительности некоторых этнических групп к воздействию этих соединений.
Принято считать, что овцы, козы, крысы и мыши являются более устойчивыми к отравлениям луком, чем другие виды домашних животных. Безопасность кормления луком скота зависит от видовой чувствительности. Так, лук может занимать относительно большую долю (20-30%) в рационе МРС без серьезных гематологических изменений. Даже при поедании достаточно большого количества лука этими животными у них наблюдается небольшая анемия, легкая гемоглобинурия и лишь в редких случаях летальный исход. В отличии от МРС, при скармливании лука КРС нужно проявлять осторожность из-за относительной восприимчивости эритроцитов этого вида животных к окислительному повреждению эритроцитов. Ежедневное скармливание лу-каможет привести к развитию кумулятивного эффекта.
Клинические признаки
Клинические признаки заболевания развиваются от 1 до 3-х дней после поедания животным токсической дозы растений рода Allium. Сероорганические соединения оказывают сильное раздражающее действие на слизистые оболочки желудочно-кишечного тракта. Поэтому первые клинические признаки заболевания ассоциированы с расстройствами желудочно-кишечного тракта - рвота, диарея, абдоминальная боль, ухудшение аппетита, депрессия и обезвоживание. Внутрисосудистый гемолиз развивается в течение нескольких дней и приводит к устойчивой гемоглобинемии, гемоглобинурии, билирубинемии с преобладанием фракции несвязанного билирубина, снижение рО2. Это проявляется анемичностью видимых слизистых оболочек, снижению СНК, появлением тахипное, тахикардии, изменением цвета мочи, общим угнетением, депрессией и непереносимостью физических нагрузок.
Описание клинического случая
В марте 2016 года в отделение терапии ИВЦ МВА поступила собака породы карликовый шпиц, 1.3 года, 3.5 кг. В анамнезе помимо прочего владельцами указывалось, что около двух дней назад животное съело около 1/2 стакана резаного репчатого лука. После этого у пациента отмечалась вялость, апатия, резкое снижение аппетита, рвота (около 2-3 р/д), не ассоциированная с приемом пищи или воды, диарея, изменение цвета мочи. Содержимое рвотных масс - желудочный сок с небольшим количеством желчи. Снижения потребления воды не отмечалось.
Объективно при осмотре:
Общее состояние животного удовлетворительное. Т=38,0 С°. Сознание ясное. Положение тела в пространстве естественное. Движения скоординированные. ВСО анемичные (Рис.5), влажные, без видимых признаков патологических изменений. СНК не определяется. Периферические ЛУ не пальпируются. Тургор кожи сохранен. Волос матовый, плохо удерживается в волосяном фолликуле. При осмотре кожи и шерстного покрова патологических изменений не выявлено. Экскурсия грудной клетки симметричная. Дыхание ритмичное, везикулярное на всем поле аускультации. Брюшная стенка мягкая, безболезненная.
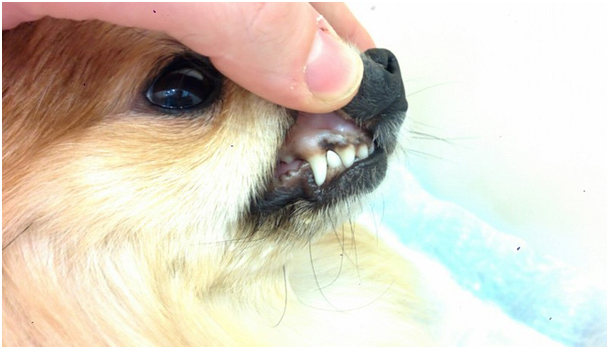
Рис.5. Анемичный вид слизистых
При выполнении гематологического исследования (Рис.6) в день обращения, помимо прочего была выявлена сильная анемия, снижение гемоглобина, повышение скорости оседания эритроцитов и появление большого количества нормобластов. Животное было переведено в отделение реанимации и интенсивной терапии ИВЦ МВА.
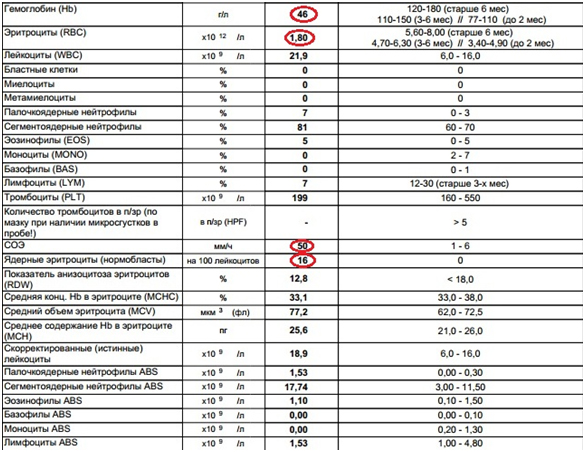
Рис.6. Клинический анализ крови в день обращения.
Сильная анемия требовала немедленной коррекции и проведения гемотрансфузии. С этой целью животному было перелито 50 мл эритроцитарной массы. Перед проведением гемотрансфузии пациенту была проведена катетеризация поверхностной вены предплечья и введено 15 мг Са-глюконата и 14 мг преднизолона. Животное было помещено в бокс для проведения активной оксигенотерапии. После гемотрансфузии выполнена внутривенная инфузия раствора Хартмана в объеме 50мл в течение 60мин. Зная основной патогенетический механизм повреждения эритроцитов, в качестве активного антиоксиданта нами был выбран 5% р-р мексидола. Мексидол обладает выраженными антиоксидантными, антигипоксическими и мембранопротекторными свойствами. Стабилизирует мембранные структуры тромбоцитов и эритроцитов при гемолизе, обладает гиполипидемическим действием, ингибирует перекисное окисление липидов, повышает активность супероксиддисмутазы. 5% раствор мексидола был назначен в дозировке 15мг/кг каждые 12 часов в течение двух дней. В последующие дни дозировка была снижена до 8мг/кг каждые 12 часов.
Промывание желудка и вызывание рвоты актуальны в первые часы после попадания в организм токсического агента, но в данном случае эти мероприятия не были бы эффективны, т.к. с момента отравления прошло более 48 часов. При этом, независимо от времени отравления, применение энтеросорбентов остается актуальным. В первые 48 часов после гемотрансфузии животному назначен преднизолон в дозировке 2.5мг/кг, каждые 12 часов. Для защиты слизистой оболочки желудка было назначено внутривенное введение 1.75мг фамотидина каждые 12 часов, а также орального введения 1.5 мл альмагеля каждые 8 часов. В качестве энтеросорбента животному был назначен энтеросгель по 2 мл внутрь каждые 8 часов, в течение 48часов. Для снижения воспалительной реакции слизистых оболочек ЖКТ животному бы-ло назначено ежедневное выпаивание 20 мл отвара цветков ромашки, с интервалами в 12 часов.
После проведенных мероприятий был осуществлен повторный забор крови для выполнения биохимического анализа и автоматического подсчета форменных элементов крови (Рис.7,8). Отмечено заметное повышение количества эритроцитов и гемоглобина.
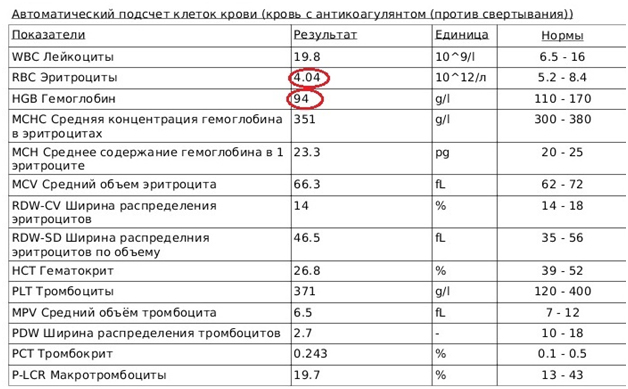
Рис.7. Автоматический подсчет клеток крови после проведенной гемотрансфузии.
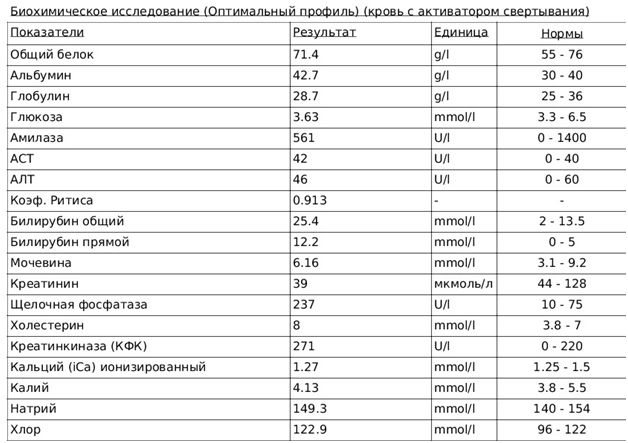
Рис.8. Биохимический анализ крови после проведенной гемотрансфузии.
Для улучшения гемопоэза животному было назначено внутримышечное введение 150 мкг цианокобаламина каждые 24 часа и 0,25 мл гемобаланса 1р/3 дня в течение недели. Продолжена внутривенная инфузия раствора Хартмана в объеме 50 мл, каждые 12 часов в течение 48 часов. В качестве гепатопротектора, для защиты гепатоцитов в условиях повышенного образования билирубина и общего токсического влияния сероорганических соединений, был назначен Гептрал – 17.5 мг, внутривенно, каждые 12часов в течение четырех дней. Через 24 часа выполнен автоматический подсчет форменных элементов крови (Рис.9).
Наблюдается рост количества эритроцитов, хотя и незначительный, и стабильный рост концентрации гемоглобина. Сохраняется стабильный лейкоцитоз. При этом с самого первого дня после обращения у животного наблюдаются все признаки хорошего регенеративного ответа со стороны красного костного мозга.
На момент выписки (3-й день с момента обращения) пациент находился в удовлетворительном состоянии. За все время нахождения животного в отделении ОРИ рвота отсутствовала. За все время лечения выраженные признаки диареи наблюдались в первые сутки, в последующее время стул мягкий неоформленный. ВСО бледно-розового цвета. Признаков дегидратации не отмечено. Перед выпиской, выполнен автоматический подсчет форменных элементов крови (Рис. 10).
Отмечено незначительное снижение концентрации гемоглобина, сохранение стабильного количества эритроцитов, сохранение стабильного лейкоцитоза. Пациенту назначена вышеуказанная терапия на 3 дня и животное переведено на амбулаторное лечение. Для стимуляции гемопоэза пациенту было однократно введено 700 МЕ эритропоэтина. В качестве лечебной диеты животному назначен корм PurinaEN, на 1 месяц.
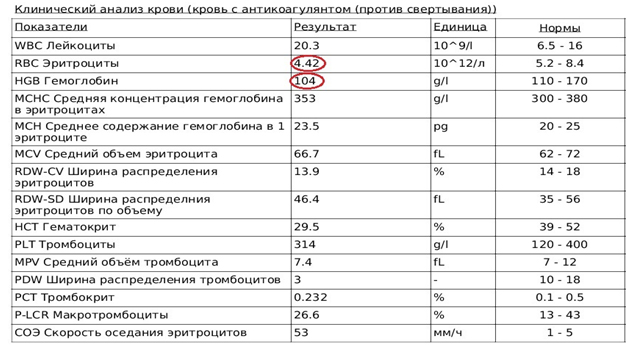
Рис.9. Автоматический подсчет клеток крови. 24 часа после поступления.
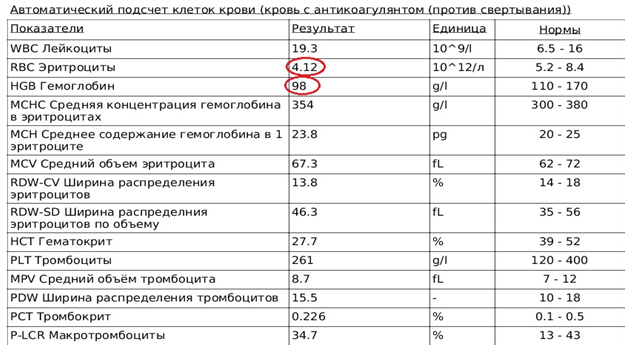
Рис.10. Автоматический подсчет клеток крови на момент выписки.
На назначенный повторный прием владельцы не пришли. Дальнейшее лечение, по желанию владельцев, осуществлялось у другого врача ИВЦ МВА, являющегося постоянным лечащим врачом. Назначенное лечение оставалось неизменным. По данным лечащего врача у животного наблюдается выраженная положительная динамика лечения. Все клинические признаки заболевания, описанные ранее, отсутствуют.
Выводы
Отравления животных растениями рода Allium являются достаточно редкими пищевыми токсикозами собак и кошек. В основном отравления происходят либо при случайном поедании животными пищевых концентратов, либо при намеренном скармливании животным корма содержащего части растений рода Allium, либо при извращении аппетита.
Эритроциты собак и кошек являются очень чувствительными к окислительному повреждению в результате воздействия таких сероорганических соединений как дипропил дисульфид, аллил пропил дисульфид и натрия-n-пропил тиосульфат, содержащихся в растениях рода Allium.
Клинические признаки проявляются в первые трое суток после отравления. Первыми клиническими признаками отравления являются симптомы расстройства ЖКТ. Стойкая гемолитическая анемия развивается минимум через 24 часа после отравления. Специфические антидоты при отравлении растениями рода Allium отсутствуют.
В первые часы после отравления эффективными являются общие методы лечения пищевых отравлений - промывание желудка, провоцирование рвоты. Применение энтеросорбентов является эффективным в любой период лечения. Основное лечение должно быть направлено на стабилизацию гематологических показателей, в частности количества эритроцитов, и фармакологическое балансирование антиаксидантной способности клеток.
При необходимости рекомендовано проведение гемотрансфузии. При эффективной терапии повторное проведение гемотрансфузии, как правило, не требуется. Необходимо контролировать водно-осмотический баланс и при необходимости принять меры к регидратации пациентов. Помимо вышеперечисленного, лечение должно быть направлено на стимуляцию гемопоэза. Постоянно необходимо оценивать степень повреждения почек и гепатоцитов печени. При необходимости следует принять меры по фармакологической протекции этих органов. В большинстве случаев заболевания прогноз лечения положительный.
Список литературы
- COPE R. B. 2005 Allium species poisoning in dogs and cats Vet Med 100 (8):562-566.
- KAY J. M. 1983 Onion toxicity in a dog. Modern Veterinary Practice 64: 477-478.
- KOBAYASHI K. 1987 The hemolytic effect of onions on canine erythrocytes associated with inherited high Na, K-ATPase activity. Japanese Journal of Veterinary Research 35: 137.
- MIYATA D. 1990 Isolation of a new phenolic compound from the onion (Allium cepa L.) and its oxidative effect on erythrocytes [abstract]. Japanese Journal of Veterinary Research 38: 65.
- SMITH C. H., ELLISON R. S. 1986 Concurrent onion poisoning and haematuria in a dog (letter). New Zealand Veterinary Journal 34: 77-78.
- SOLTER P., SCOTT R. 1987 Onion ingestion and subsequent Heinz body anemia in a dog: A case report. Journal of the American Animal Hospital Association 23: 544-546.
- YAMOTO O., MAEDE Y. 1992 Susceptibility to onion-induced hemolysis in dogs with heredity high erythrocyte reduced glu
- R. GUITART , C. MATEU , A. LOPEZ I AGULLO , J. ALBEROLA. 2008 Heinz body anaemia in two dogs after Catalan spring onion (“calcot”) ingestion: a case reports. Veterinarni Medicina, 53, 2008 (7): 392–395



